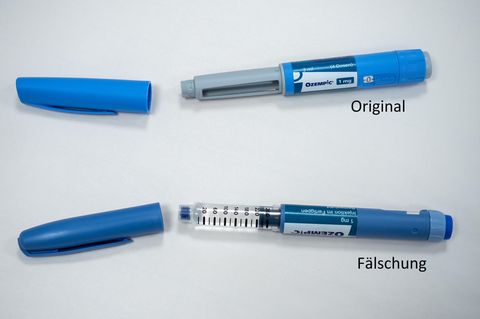
Wenn ein Pharmakonzern ein neues Medikament auf den deutschen Markt bringen will, muss es sich zuvor beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) um die Zulassung bemühen. Hierzu muss das Unternehmen die Wirkung, und die Nebenwirkungen des Medikaments genau dokumentieren.
Zuerst wird der Wirkstoff im Reagenzglas und in Tierversuchen getestet. Anschließend ist es jedoch nötig, die Wirkung des Medikaments und eventuelle Nebenwirkungen auch am Menschen zu untersuchen. Diese Tests werden "klinische Studien” oder auch "klinische Prüfungen" genannt. Für ihren Ablauf gibt es einen strengen gesetzlichen Rahmen, der die Probanden schützen soll. In Deutschland müssen sich Ärzte bei der Planung einer klinischen Studie von einer Ethik-Kommission beraten lassen. Die Tests dürfen erst beginnen, wenn die Ethik-Kommission zugestimmt hat.
Klinische Prüfung in drei Phasen
In der ersten Phase der klinischen Prüfung nehmen in der Regel zehn bis zwanzig Probanden das Medikament ein. Damit die Ergebnisse nicht durch die Erwartungshaltung der Teilnehmer verfälscht werden, werden sie aufgeteilt in eine Versuchsgruppe und eine Kontrollgruppe, wobei die Kontrollgruppe ein wirkungsloses Scheinmedikament (Placebo) erhält. Den Probanden wird jedoch nicht mitgeteilt, welcher Gruppe sie zugeordnet wurden. Bei so genannten Doppelblindstudien wissen auch die Ärzte nicht, wer das Placebo erhält und wer den neuen Wirkstoff.
Treten in der ersten Phase keine Nebenwirkungen auf, wird die Gruppe der Probanden vergrößert: Mehr als 100 Patienten erhalten nun das Medikament. Neben der Verträglichkeit des Mittels steht hier außerdem die Dosierung im Fokus der Ärzte: Sie versuchen herauszufinden, welche Wirkstoffmenge die beste Wirkung erzielt, ohne dass zu große Nebenwirkungen auftreten.
Zum Abschluss werden 500 Patienten mit dem Medikament behandelt. Sind alle drei Testphasen der klinischen Prüfung ohne Auffälligkeiten verlaufen, erteilt das BfArM die Zulassung - zunächst für fünf Jahre.